Cílem projektu studie EPCS II je porovnání klinického stavu pacientů, kteří po splnění indikačních kritérií podstoupili epiduroskopický výkon.
Studie EuroPainClinicsStudy II (EPCS II) objektivizuje přínos miniinvazivního algeziologického výkonu – epiduroskopie u pacientů s bolestmi zad, kteří prodělali jednu nebo několik neúspěšných operací páteře a trpí tzv. syndromem selhání chirurgické léčby zad (failed back surgery syndrome – FBSS). Studie je zaměřena na sledování dlouhodobé úlevy od bolesti a zlepšení kvality života těchto pacientů.
Dne 23. 4. 2015 byla studie schválena regionální nemocniční etickou komisí pod číslem EK:75/EK/15. Následně byla zaregistrována v mezinárodní databázi National Health Service USA. https://clinicaltrials.gov PRS: NCT02459392 EPCS 2 Approval document. Projekt splňuje všechny atributy a platné legislativní normy týkající se medicínského výkonu schváleného Ministerstvy zdravotnictví v SR a ČR.
Detail studie
Studie EuropainclinicsStudy II (EPCS II) objektivizuje přínos miniinvazivního algeziologického výkonu – epiduroskopie.
Výkon epiduroskopie – indikační kritéria
Studie EuropainclinicsStudy II (EPCS II) objektivizuje přínos miniinvazivního algeziologického výkonu – epiduroskopie u pacientů s bolestmi zad, kteří prodělali jednu nebo několik neúspěšných operací páteře a trpí tzv. syndromem selhání chirurgické léčby zad (failed back surgery syndrome – FBSS). Studie je zaměřena na sledování dlouhodobé úlevy od bolesti a zlepšení kvality života těchto pacientů.
Předmět studie EPCS II a registrace
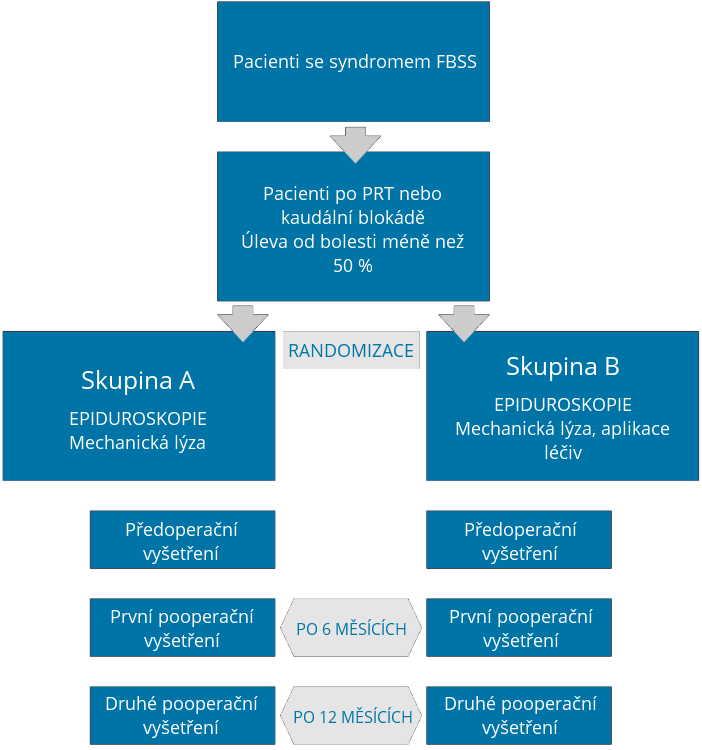
Předmětem projektu je realizace multicentrické dvojitě zaslepené randomizované klinické studie zabývající se porovnáním dvou metodických postupů provedení epiduroskopického výkonu u pacientů s FBSS.
Studie byla připravena a vypracována organizací Europainclinics z.ú. Po vypracování designu studie, přípravě informovaných souhlasů pro její účastníky a vyhotovení protokolu byla studie dne 23. 4. 2015 schválena regionální nemocniční etickou komisí pod číslem EK: 75/EK/15) Následně byla zaregistrována v mezinárodní databázi National Health Service USA https://clinicaltrials.gov PRS: NCT02459392.
Projekt splňuje všechny atributy a platné legislativní normy týkající se medicínského výkonu schváleného Ministerstvy zdravotnictví v SR a ČR. Zpracování osobních údajů pacientů pro účely studie je prováděno v souladu se současnou verzí Helsinské deklarace z roku 2008 a zároveň v souladu s příslušnými zákony dané země. Ochrana osobních údajů pacienta bude zachována. Nakládání s údaji bude probíhat podle požadavků směrnic EU: směrnice 95/46/ES, směrnice 2002/58/ES, směrnice 2006/24/ES. Bude zajištěno, aby protokol studie, informované souhlasy s intervenčním výkonem a s probíhající studií byly podle místních požadavků předloženy příslušné nezávislé etické komisi. Pokud to zákony dané země vyžadují, ponese společnost EuroPainClinics z.ú. odpovědnost za předložení každoroční aktualizace dokumentace nezávislé etické komisi. Výsledky dosažené ve studii budou publikovány v odborných mezinárodních periodicích a zohledněny v doporučeních a postupech pro klinickou praxi intervenční algeziologie.
Průběh studie EPCS II
Cílem projektu bude porovnání dvou skupin pacientů, kteří podstoupí epiduroskopický výkon. Ve skupině A pacientů bude během epiduroskopie vykonána pouze mechanická lýza fibrózních srůstů. Ve skupině B pacientů bude současně s mechanickou lýzou adhezí provedena aplikace kortikoidů – depo-medrolu a hyázy. Během adheziolýzy lékař cíleně pod vizuální kontrolou rozruší srůsty, které se upínají na postižený nerv nebo duru. Mohou být odstraněny mechanicky – strhnutím špičkou vizuálně naváděného epiduroskopu nebo tlakem při proplachování fyziologickým roztokem. Mezi pokročilé metody mechanického rozrušování srůstů patří lýza laserem a pulzní radiofrekvenční ablací. Léčiva lokálně aplikovaná do epidurálního prostoru během výkonu a jejich předpokládaný efekt: hyáza se může podílet na rušení srůstů, a to mechanismem enzymatického štěpení. V případě depomedrolu se předpokládá jeho protizánětlivý účinek v místě aplikace a následná tendence k redukci zánětlivé odpovědi, migrace buněk, otoku, bolesti a tvorby srůstů. Bez ohledu na tyto teoretické předpoklady účinku podávaných léčiv nebyl dodnes ve výsledcích publikovaných studií verifikován jejich přínos, a proto se podání těchto léčiv považuje za diskutabilní.
Cíle studie EPCS II a sledované parametry
Cílem projektu je porovnání klinického stavu pacientů, kteří po splnění indikačních kritérií podstoupili epiduroskopický výkon a byli zařazeni do studie EPCS II. Ze sledovaných parametrů se bude porovnávat klinický stav, vizuální škála bolesti, celkové skóre bolesti, šíření bolesti v příslušných dermatomech, snížení spotřeby analgetik a dotazník Oswestry (hodnotící kvalitu života u pacientů s bolestí lumbosakrální páteře). Sledované parametry budou zaznamenávány v třech časových úsecích, a to před výkonem (první vyšetření), následně 6 měsíců po výkonu (druhé vyšetření) a nakonec 12 měsíců po výkonu (třetí vyšetření). Výsledky budou následně podrobeny statistické analýze. Dalším cílem projektu je zveřejnění zjištěných výsledků v odborných mezinárodních periodicích.