Cílem projektu EPCS III je objektivizace přínosu miniinvazivní algeziologické techniky u pacientů s vertebroalgickým syndromem a kvantifikace dlouhodobé úlevy od bolesti a zlepšení kvality života pacientů po výkonu Disc FX na meziobratlové ploténce u vybrané skupiny pacientů po splnění indikačních kritérií.
Studie byla dne 23. 4. 2015 schválená regionální etickou komisí pod číslem EK: 9N-2015. Následně byla zaregistrována v mezinárodní databázi National Health Service USA https://clinicaltrials.gov PRS: NCT02461654
EPCS 3 Approval document.
Projekt splňuje všechny atributy a platné legislativní normy týkající se medicínského výkonu schváleného Ministerstvy zdravotnictví v SR a ČR.
Detail studie
Studie EuroPainClinicsStudy III (EPCS III) je zaměřena na klinický výzkum léčebné metody Disc FX.
Disc FX – indikační kritéria
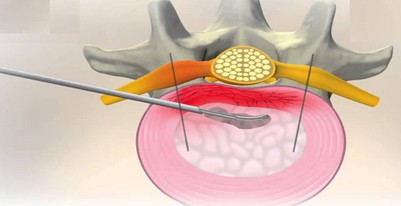
Disc FX je inovační systém umožňující bezpečný a účinný přístup k postižené meziobratlové ploténce bez poškození okolních struktur. Tato metoda představuje možnost pro ty, u nichž nebyla konzervativní léčba úspěšná a kteří ještě nejsou připraveni na složitou operaci. Jde o miniinvazivní zákrok vykonávaný ambulantně. Výkon zahrnuje tři fáze. V první z nich se ploténka napíchne speciální jehlou, která slouží jako pracovní kanál. Pomocí této jehly se vybere část degenerované vnitřní tkáně. Potom se ploténka radiofrekvenční sondou zataví, aby se snížilo riziko opakovaného výhřezu. Na závěr se radiofrekvenčně zničí patologické nervy v zadní části ploténky.
Studie EPCS III je zaměřena na sledování dlouhodobé úlevy od bolesti a zlepšení kvality života u vybrané skupiny pacientů po splnění indikačních kritérií, kteří podstoupili miniinvazivní výkon na meziobratlové ploténce Disc FX.
Předmět studie EPCS III a registrace
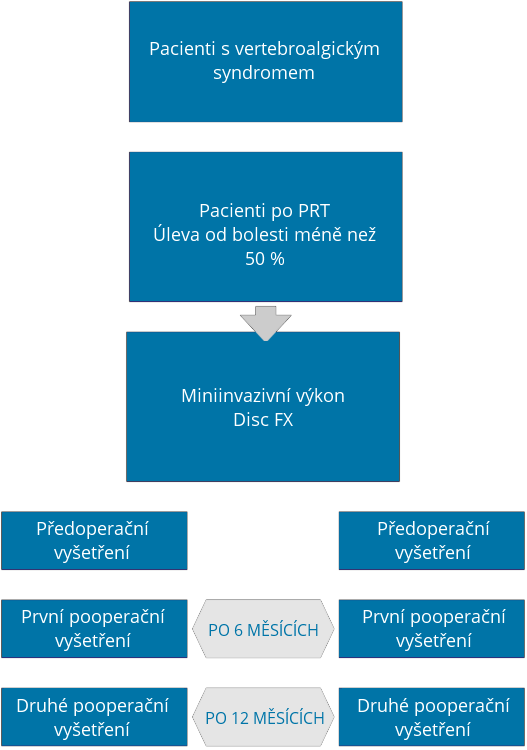
Předmětem projektu je realizace multicentrické prospektivní observační klinické studie zabývající se porovnáním vývoje klinického stavu pacienta ve třech časových úsecích, a to před výkonem a následně po 6 měsících od výkonu a po 12 měsících od výkonu.
Studie byla připravena a vypracována organizací Europainclinics z.ú. Po vypracování designu studie, přípravě informovaných souhlasů pro její účastníky a vyhotovení protokolu byla studie dne 23. 4. 2015 schválena regionální etickou komisí pod číslem EK: 9N-2015. Následně byla zaregistrována v mezinárodní databázi National Health Service USA https://clinicaltrials.gov PRS: NCT02461654.
Projekt splňuje všechny atributy a platné legislativní normy týkající se medicínského výkonu schváleného ministerstvy zdravotnictví v SR a ČR. Zpracování osobních údajů pacientů pro účely studie je prováděno v souladu se současnou verzí Helsinské deklarace z roku 2008 a zároveň v souladu s příslušnými zákony dané země. Ochrana osobních údajů pacienta bude zachována. Nakládání s údaji bude probíhat podle požadavků směrnic EU: směrnice 95/46/ES, směrnice 2002/58/ES, směrnice 2006/24/ES. Bude zajištěno, aby protokol studie, informované souhlasy s intervenčním výkonem a se zařazením do probíhající studie byly podle místních požadavků předloženy příslušné nezávislé etické komisi. Pokud to zákony dané země vyžadují, ponese společnost EuroPainClinics z.ú. odpovědnost za předložení každoroční aktualizace dokumentace nezávislé etické komisi. Výsledky dosažené ve studii budou publikovány v odborných mezinárodních periodicích a zohledněny v doporučeních a postupech pro klinickou praxi intervenční algeziologie.
Cíle studie EPCS III a sledované parametry
Cílem projektu je objektivizace přínosu miniinvazivní algeziologické techniky u pacientů s vertebroalgickým syndromem a kvantifikace dlouhodobé úlevy od bolesti a zlepšení kvality života pacientů po výkonu Disc FX. Získané výsledky budou porovnány s výsledky jiných algeziologických pracovišť světa.
Ze sledovaných parametrů se bude porovnávat klinický stav, vizuální škála bolesti, celkové skóre bolesti, šíření bolesti v příslušných dermatomech, snížení spotřeby analgetik a dotazník Oswestry (hodnotící kvalitu života pacientů s bolestí lumbosakrální páteře). Sledované parametry budou zaznamenávány ve třech časových úsecích, a to před výkonem (první vyšetření), následně 6 měsíců po výkonu (druhé vyšetření) a nakonec 12 měsíců po výkonu (třetí vyšetření). Výsledky budou následně podrobeny statistické analýze. Dalším cílem projektu je zveřejnění zjištěných výsledků v odborných mezinárodních periodicích.
